Spektren zweiatomiger Moleküle

Petra Nordinghaus-Martin
Atom- und Molekülphysik, Molekülspektren, die sich vom fernen Ultrarot bis zum ultravioletten Spektralbereich erstrecken und durch Rotations-, Schwingungs- und Elektronenübergänge sowie deren Kombination entstehen (Spektren mehratomiger Moleküle).
1) Rotationsspektren entstehen durch Absorption des Moleküls im fernen Ultrarot-Bereich (10-200 cm-1; Ultrarotspektroskopie). Zweiatomige, polare Moleküle (z. B. Halogenwasserstoff) zeigen eine nahezu äquidistante Folge von Linien, deren Frequenzdifferenz mit abnehmender Frequenz minimal zunimmt. Je schwerer die Moleküle sind, um so weiter verschieben sich die Linien zu grösseren Wellenlängen. Durch die Energieaufnahme im Ultrarot-Bereich werden Strahlungsübergänge zwischen verschiedenen Rotationszuständen des polaren Moleküls induziert. Wird das Molekül als starrer Rotator betrachtet, dessen Atome keine Schwingungen ausführen, ergibt sich aus der Quantisierung des Drehimpulsquadrats für die Rotationsenergie Erot:
![]()
wobei q das Trägheitsmoment des Moleküls und J = 0, 1, 2, ... die Rotationsquantenzahl ist (Abb. 1;
Drehbewegung, Drehimpuls). Für Übergänge von tieferen zu höheren Energieniveaus
gilt die Auswahlregel DJ = ±1. Die Frequenz des Übergangs von J nach J + 1 beträgt ![]() , d.h.
benachbarte Linien haben eine konstante Frequenzdifferenz. Im Modell des
nichtstarren Rotators wird die Rotationsenergie mit einem Korrekturfaktor
versehen, der proportional zu [J (J + 1)]2 ist, die Spektrallinien rücken dann mit wachsendem J etwas zusammen.
, d.h.
benachbarte Linien haben eine konstante Frequenzdifferenz. Im Modell des
nichtstarren Rotators wird die Rotationsenergie mit einem Korrekturfaktor
versehen, der proportional zu [J (J + 1)]2 ist, die Spektrallinien rücken dann mit wachsendem J etwas zusammen.
Die Anzahl und die Intensität der Spektrallinien hängt von der Besetzung der einzelnen Rotationsniveaus ab (Boltzmann-Verteilung).
2) Rotationsschwingungsspektren entstehen durch Absorption
bzw. Emission des Moleküls im nahen Infrarot-Bereich (2 × 102 - 2 × 104 cm-1;
Infrarot-Spektroskopie), wobei die Rotationen und Schwingungen des Moleküls
gleichzeitig verändert werden. Dabei entspricht jede Bande des
Rotationsschwingungsspektrums einem bestimmten Schwingungsübergang
(Bandenspektren). Bei zweiatomigen, polaren Molekülen bestehen die Banden aus
Doppelbanden (Bjerrum-Banden), deren Feinstruktur aus einer nahezu
äquidistanten Folge von Linien besteht (siehe Abb. 2). Die Wellenzahlen der
Linienfolge können mit Hilfe der Deslandresschen Bandenformel bestimmt werden.
Die gegeneinander schwingenden Atome des Moleküls bilden in einfachster
Näherung einen harmonischen Oszillator mit äquidistanten, diskreten
Energieniveaus (Oszillator). Für Strahlungsübergänge zwischen Oszillatorniveaus
gilt die Auswahlregel ![]() , d.h.
, d.h. ![]() für Absorption und
für Absorption und ![]() für Emission. Im Modell des anharmonischen
Oszillators sind die Energieniveaus nicht mehr äquidistant, sondern rücken mit
zunehmender Schwingungsquantenzahl näher zusammen und konvergieren gegen die
Dissoziationsenergie des Moleküls (Dissoziation). Die Rotationsenergien sind um
etwa zwei Grössenordnungen kleiner als die Schwingungsenergien. Im
Rotationsschwingungsspektrum sind die Rotationsübergänge als Feinstruktur der
Spektrallinien erkennbar.
für Emission. Im Modell des anharmonischen
Oszillators sind die Energieniveaus nicht mehr äquidistant, sondern rücken mit
zunehmender Schwingungsquantenzahl näher zusammen und konvergieren gegen die
Dissoziationsenergie des Moleküls (Dissoziation). Die Rotationsenergien sind um
etwa zwei Grössenordnungen kleiner als die Schwingungsenergien. Im
Rotationsschwingungsspektrum sind die Rotationsübergänge als Feinstruktur der
Spektrallinien erkennbar.
3) Elektronenspektren entstehen durch Absorption bzw. Emission (elektrische Entladungen, Flammen, Fluoreszenz) des Moleküls im sichtbaren und ultravioletten Spektralbereich (104 - 105 cm-1; Infrarot-Spektroskopie). Ähnlich wie bei Atomspektren werden die Elektronenspektren zweiatomiger Moleküle durch Übergänge zwischen Zuständen unterschiedlicher Elektronenanregungsenergie verursacht (Elektronenzustände mehratomiger Moleküle, Elektronenzustände zweiatomiger Moleküle). Die Energiedifferenzen zwischen den verschiedenen Elektronenzuständen eines zweiatomigen Moleküls liegen in der gleichen Grössenordnung wie bei den Atomen. Die Energie des Moleküls setzt sich zusammen aus der Elektronenenergie Ee (Energiewert des Potentialminimums), der Schwingungsenergie Ev und der Rotationsenergie Er: E = Ee + Ev + Er. Das Termschema zweiatomiger Moleküle zeigt demnach eine Dreiteilung, wobei die Grobstruktur durch die verschiedenen Elektronenzustände bestimmt wird; jeder Elektronenzustand fächert auf in eine Reihe von Schwingungszuständen, und jeder Schwingungszustand zeigt seinerseits wieder eine Unterteilung in verschiedene mögliche Rotationszustände (Elektronenschwingungsspektrum). Diese Struktur des Energieniveauschemas spiegelt sich auch in den Spektren wider.
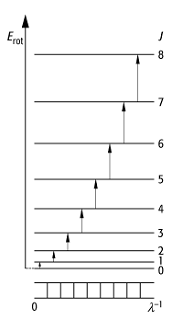
Spektren zweiatomiger Moleküle 1: Energieniveauschema, Übergänge und schematisches Spektrum des starren Rotators. J: Rotationsquantenzahl (J = 0, 1, 2, ...).
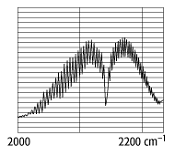
Spektren zweiatomiger Moleküle 2: Rotationsschwingungsbande (Doppelbande, Bjerrum-Bande) des Kohlenmonoxidmoleküls.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.