molekulare Oberfläche

Petra Nordinghaus-Martin
Laserphysik und -technik, Modellvorstellung zur Beschreibung von Wechselwirkungen zwischen Molekülen. Der physikalische Ansatz einer Oberfläche ist immer dann geeignet, wenn sich physikalische Grössen in eng begrenzten Räumen stark ändern, welche sich im gegeben Fall nur in zwei Dimensionen ausdehnen. In der molekularen Biophysik spielen zwei Arten von molekularen Oberflächen neben anderen Definitionen eine grosse Rolle: (1) die Van-der-Waals-Oberfläche und (2) die lösungsmittelzugängliche Oberfläche.
Die Van-der-Waals-Oberfläche ist definiert als der geometrische Ort aller Punkte auf einer Van-der-Waals-Kugel, deren Zentrum der jeweilige Atommittelpunkt ist. Die Punkte einer Van-der-Waals-Oberfläche dürfen dabei nicht gleichzeitig innerhalb der Van-der-Waals-Kugel eines anderen Atomes liegen. Die Summe der Radien zweier Van-der-Waals-Kugeln ist definiert als die minimal mögliche, spannungsfreie Annäherung zwischen zwei Atomen und kann experimentell, z.B. aus Kristallgeometrien, bestimmt werden; daraus berechnet man die Radien der einzelnen Atome (Tabelle). Der physikalische Hintergrund ist die exponentiell abfallende Abstossung zwischen sehr nahen Atomen; die sogenannte Van-der-Waals-Wechselwirkung wird Null beim Van-der-Waals-Radius. Die Van-der-Waals-Oberfläche ist ein wichtiges Hilfsmittel zum Studium der spannungsfreien Packungsgeometrien in Molekülkristallen bzw. bei der Konformation von Polymeren (Biomakromoleküle, Konformationsenergie).
Die lösungsmittelzugängliche Oberfläche ist der geometrische
Ort der Mittelpunkte einer Testkugel, welche über die Van-der-Waals-Oberfläche
rollt. Der Radius der Testkugel sollte dem Lösungsmittel entsprechen, für
Wasser ist er 1,4 Å = 0,14 nm. Formal ist die lösungsmittelzugängliche
Oberfläche identisch mit der Van-der-Waals-Oberfläche, wenn alle Atomradien um
den Probenkugelradius inkrementiert werden. Der Sinn der
lösungsmittelzugänglichen Oberfläche, welche zum Studium der Hydration von
Biomakromolekülen entwickelt wurde, ergibt sich daraus, dass ein Makromolekül
hauptsächlich mit der ersten Schicht von Lösungsmittelmolekülen wechselwirkt
(Solvatation, Hydratation). Eine wesentliche Komponente der
Konformationsenergie, die kurzreichweitigen Wechselwirkungen E mit dem Lösungsmittel, kann als Funktion proportional
zur lösungsmittelzugänglichen Oberfläche Ai
der Atome i dargestellt werden, ![]() .
.
Der Proportionalitätsfaktor si ist z.B. für aliphatische Kohlenstoffatome (CH3-und CH2-Gruppen) ca. +80 J / (mol Å2). Interessanterweise ist die lösungsmittelzugängliche Oberfläche in der Regel für die native Struktur von Proteinen viel kleiner als die Van-der-Waals-Oberfläche, weil die Probenkugel nicht in die vielen kleinen Invaginationen und Höhlen der Van-der-Waals-Oberfläche eindringen kann.
Bei der Berechnung der molekularen Oberflächen gibt es zwei prinzipielle Herangehensweisen. Die analytische Methode basiert auf Verfahren der Differentialgeometrie. Numerische Verfahren basieren auf der Zerlegung der Oberfläche in schmale Streifen oder kleine Flecken. Man kann z.B. die Punkte der Tesselation einer Einheitskugel auf die Van-der-Waals-Kugeln projizieren und deren Anteil auf der molekularen Oberfläche bestimmen. In diesem Fall hängt die Genauigkeit der Oberflächenberechnung von der Punktdichte ab.
molekulare Oberfläche: Typische Van-der-Waals-Radien von Atomen in bioorganischen Molekülen. Um die Anzahl der Atome zu verringern, vereinigt man oft die gebundenen Wasserstoffatome mit dem zentralen schweren Atom zu einer Einheit mit einem leicht vergrösserten Radius.
| bottom:solid black 1.5pt;border-right:
none;mso-border-top-alt:solid black .75pt;mso-border-left-alt:solid black .75pt;
mso-border-bottom-alt:solid black 1.5pt;padding:0cm 3.55pt 0cm 3.55pt\'>
Atomtyp |
bottom:solid black 1.5pt;border-right:solid black 1.0pt;
mso-border-top-alt:solid black .75pt;mso-border-bottom-alt:solid black 1.5pt;
mso-border-right-alt:solid black .6pt;padding:0cm 3.55pt 0cm 3.55pt\'>
Van-der-Waals-Radius (in nm) |
|
H |
0,110 |
|
C |
0,160 |
|
CH2, CH3 |
0,190 |
|
O |
0,140 |
|
N |
0,150 |
|
P |
0,190 |
| bottom:solid black 1.0pt;border-right:none;
mso-border-left-alt:solid black .75pt;mso-border-bottom-alt:solid black .75pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
S |
bottom:solid black 1.0pt;border-right:solid black 1.0pt;
mso-border-bottom-alt:solid black .75pt;mso-border-right-alt:solid black .75pt;
padding:0cm 3.55pt 0cm 3.55pt\'>
0,185 |
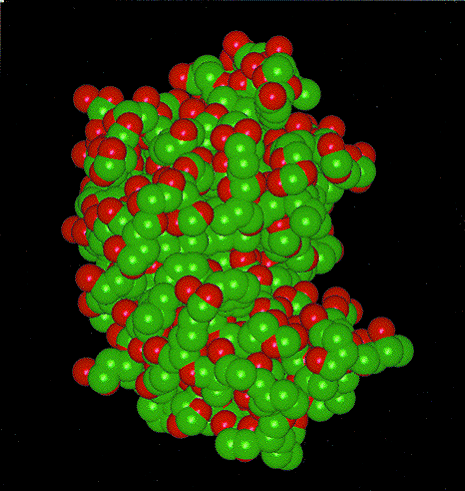
molekulare Oberfläche 1: Darstellung der Van-der-Waals-Oberfläche von Lysozym.
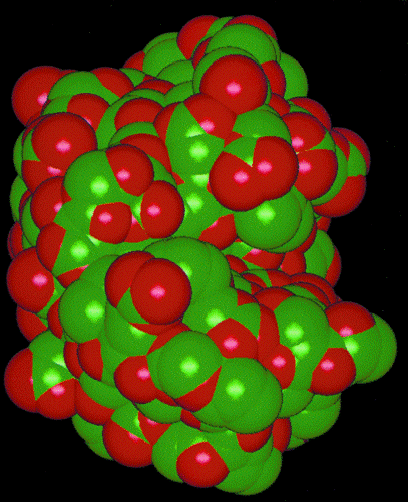
molekulare Oberfläche 2: Darstellung der lösungsmittelzugänglichen Oberfläche von Lysozym. Diese Oberfläche hat weniger Details als die Van-der-Waals-Oberfläche, insbesondere weniger Invaginationen und (intramolekulare) Höhlen, es tragen auch bedeutend weniger Atome zu der Oberfläche bei.
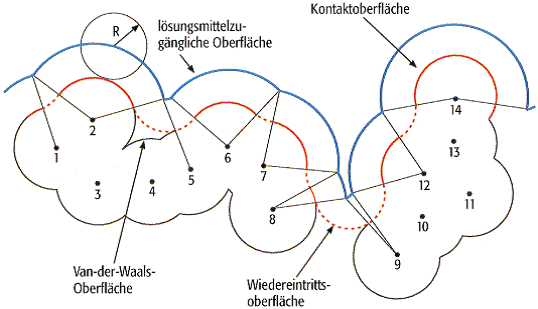
molekulare Oberfläche 3: Definition von molekularen Oberflächen. Der Schnitt durch ein fiktives Molekül, bestehend aus den Atomen 1-14, wird gezeigt. Die Van-der-Waals-Oberfläche und die lösungsmittelzugängliche Oberfläche bestehen aus Stücken von Kugeln, deren Zentren an den Atompositionen lokalisiert sind und welche nicht von benachbarten Kugeln verdeckt werden. Im Falle der Van-der-Waals-Oberfläche ist der Atomradius gleich dem sogenannten Van-der-Waals-Radius, im Falle der lösungsmittelzugänglichen Oberfläche wird dieser Radius um den Radius R einer Testkugel, welche das Lösungsmittel modelliert, inkrementiert (gewöhnlich 1,4 Å für Wasser). Die sogenannte Kontaktoberfläche (nach M. Connolly) ist teilweise identisch mit der Van-der-Waals-Oberfläche. Die sogenannte Wiedereintrittsoberfläche wird durch Testkugeln bei Invaginationen gebildet, welche zu klein sind, um die Testkugel durchtreten zu lassen.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.