Wasser

Hans-Peter Ahlsen
Umwelt- und GeophysikChemie, Physikalische Chemie, chemische Verbindung aus zwei Wasserstoffatomen und einem Sauerstoffatom (siehe Abb.), die in drei Aggregatzuständen (Dampf, flüssig, Eis) vorkommt. Seine Dichte beträgt 0,999841 × 103 kg m-3 (bei 0 °C). Wasser wurde schon von den Griechen als eines der Grundelemente (Feuer, Wasser, Luft, Erde) beschrieben, ohne das kein Leben möglich ist, und ist heute Forschungsgegenstand der Hydrologie. In der Natur existieren mehrere stabile Wasserisotope, welche u.a. für die Klimaforschung von Bedeutung sind (Isotopenhydrologie, Wasserkreislauf).
Wasser ist im Organismus und im Boden sowohl Lösungs- und Transportmittel für Nährstoffe als auch Lösungsmittel für Substanzen und Reaktionsprodukte. Die chemischen Reaktionen des Stoffwechsels und der Strukturaufbau von Biomakromolekülen (Proteine, Nucleinsäuren, Kohlenhydrate) laufen in wässrigem Medium ab. Beispielsweise ordnen sich bei der Proteinfaltung in der Zelle hydrophobe Gruppen nach innen und wenden sich damit vom Wasser ab, während hydrophile Gruppen auf der Moleküloberfläche (und z.T. im aktiven Zentrum) dem wässrigem Milieu präsentiert werden.
Wasser besitzt eine aussergewöhnlich hohe Dielektrizitätskonstante und die Fähigkeit, polare, insbesondere ionische Verbindungen, zu lösen. Ursache des Dipolcharakters des H2O-Moleküls sind dessen Bindungspolarität und gewinkelter Bau. Aus der Dipolnatur resultiert auch das Solvatationsvermögen des Wassers, das sowohl über Donor- als auch Akzeptoreigenschaften verfügt. Somit vermag Wasser sowohl Anionen als auch Kationen zu solvatisieren. Damit im Zusammenhang steht die ausgesprochene Tendenz vieler Verbindungen, in wässriger Lösung in Ionen zu dissoziieren. Insbesondere kleine, hoch geladene Ionen werden dabei von einer relativ stabilen Hydrathülle umgeben (Aquakomplexe), die oft auch bei der Kristallisation der Salze aus der wässrigen Lösung erhalten bleibt (Kristallwasser). Bei den organischen Verbindungen unterscheidet man entsprechend dem Gehalt an hydrophilen und hydrophoben Gruppierungen Stoffklassen, die sich gut in Wasser lösen (Aminosäuren, Proteine, Nucleinsäuren und Kohlenhydrate), und solche, die sich nur schwer in Wasser lösen (Fette und Lipide).
Auf Grund der Bindungspolarität und der Verfügbarkeit freier Elektronenpaare am Sauerstoffatom bildet Wasser stabile Wasserstoffbrückenbindungen aus.
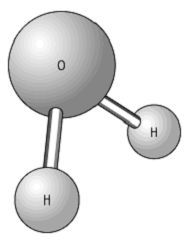
Wasser: Wassermolekül H2O.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.