Siedepunkt

Petra Nordinghaus-Martin
Chemie, Physikalische Chemie, Siedetemperatur, die Temperatur, bei der die flüssige und die gasförmige Phase eines Stoffs im thermodynamischen Gleichgewicht stehen. Der Siedepunkt ist identisch mit dem Kondensationspunkt eines Gases. Unter normalem Siedepunkt versteht man die Temperatur, bei der der Dampfdruck der Flüssigkeit mit dem Normaldruck (101,3 kPa) übereinstimmt. Reine Stoffe haben einen konstanten Siedepunkt. Bei Stoffgemischen steigt der Siedepunkt während des Siedens an, da zunächst die leichter flüchtigen Komponenten verdampfen (Siedediagramm). Solche Gemische können durch Destillation getrennt werden. Azeotrope können einen Siedepunkt besitzen, der entweder höher als die am höchsten siedende Komponente liegt oder niedriger als die am niedrigsten siedende Komponente des Gemisches. Lösungen, die eine Komponente mit niedrigem Dampfdruck gelöst enthalten, zeigen eine Siedepunktserhöhung. Der Siedepunkt kann daher als Reinheitskriterium herangezogen werden.
Der Siedepunkt ist stark druckabhängig (siehe Abb.). Er kann entweder mit Hilfe des Dampfdruckdiagramms oder der Clausius-Clapeyron-Gleichung bestimmt werden (Siedepunkte der Elemente: siehe Zusatzinformationen). Zahlreiche organische Verbindungen zersetzen sich beim Siedepunkt. Für diese Substanzen wird der Siedepunkt bei vermindertem Druck bestimmt und dieser als Index an die Abkürzung Sdp. angefügt.
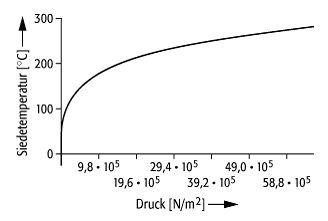
Siedepunkt: Verlauf der Siedetemperatur von Wasser in Abhängigkeit vom Druck.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.