Clausius-Clapeyron-Gleichung

Martina Wagner
von B. Clapeyron 1834 erstmals aufgestellte und von R.J.E. Clausius 1850 erstmals in ihrer allgemeinen Form angegebene Gleichung für die Temperaturabhängigkeit des Gleichgewichtsdruckes p(T) bei Phasengleichgewichten:
![]() (1)
(1)
Hierbei bedeuten T die Umwandlungstemperatur, q
die molare Umwandlungswärme, ![]() 1 und
1 und ![]() 2 die molaren Volumina
der beiden Phasen. Wendet man auf den Dampfzustand die idealen Gasgesetze an
und vernachlässigt man das Molvolumen des flüssigen Zustandes gegen das
Molvolumen des gasförmigen Zustandes (
2 die molaren Volumina
der beiden Phasen. Wendet man auf den Dampfzustand die idealen Gasgesetze an
und vernachlässigt man das Molvolumen des flüssigen Zustandes gegen das
Molvolumen des gasförmigen Zustandes (![]() fl <<
fl << ![]() g), so lässt sich die
Clausius-Clapeyron-Gleichung in der Form
g), so lässt sich die
Clausius-Clapeyron-Gleichung in der Form
![]() (2)
(2)
angeben, wobei DH die Differenz der Verdampfungsenthalpien beider Zustände und R die allgemeine Gaskonstante ist. Die Gleichung (2) hat eine formale Ähnlichkeit zur Van-t\'Hoff-Gleichung und ist in der physikalischen Chemie verbreitet.
Unter der Voraussetzung, dass die Verdampfungsenthalpie nicht von der Temperatur abhängt, kann man (2) integrieren, und man erhält Wertepaare von Druck und Temperatur (p,T; p*,T*), bei der beide Phasen koexistieren:
![]() .
.
Diese Gleichung beschreibt den Verlauf der Dampfdruckkurve. Sie endet am kritischen Punkt (pkrit,Tkrit), an dem die flüssige Phase verschwindet und nur noch die Gasphase existiert (Abb.).
Die Clausius-Clapeyron-Gleichung lässt sich direkt aus der
Gleichgewichtsbedingung für die Koexistenz zweier Phasen ![]() : chemische
Potentiale) ableiten. Die Gültigkeit der Clausius-Clapeyron-Gleichung ist auf
bestimmte Phasengleichgewichte, die sog. Phasenreaktionen, beschränkt,
bei denen die beiden betrachteten Phasen die gleiche Zusammensetzung haben. Da
dies bei einkomponentigen Systemen stets der Fall ist, gilt die
Clausius-Clapeyron-Gleichung für deren Schmelz-, Siede-,
Sublimationsgleichgewichte und polymorphe Umwandlungen. q ist dann
jeweils die entsprechende Umwandlungswärme, T,
: chemische
Potentiale) ableiten. Die Gültigkeit der Clausius-Clapeyron-Gleichung ist auf
bestimmte Phasengleichgewichte, die sog. Phasenreaktionen, beschränkt,
bei denen die beiden betrachteten Phasen die gleiche Zusammensetzung haben. Da
dies bei einkomponentigen Systemen stets der Fall ist, gilt die
Clausius-Clapeyron-Gleichung für deren Schmelz-, Siede-,
Sublimationsgleichgewichte und polymorphe Umwandlungen. q ist dann
jeweils die entsprechende Umwandlungswärme, T, ![]() und
und ![]() die entsprechende Temperatur und molaren
Volumina und
die entsprechende Temperatur und molaren
Volumina und ![]() die Neigung der Umwandlungskurve.
die Neigung der Umwandlungskurve.
Bei mehrkomponentigen Systemen gibt es Phasenreaktionen nur
bei bestimmten Zusammensetzungen, z.B. beim Übergang flüssig - gasförmig bei
azeotropen Mischungen und beim Übergang fest - flüssig bei der eutektischen
Zusammensetzung. Ausserdem lässt sich die Clausius-Clapeyron-Gleichung bei
Lösungsgleichgewichten anwenden. q ist dann die Verdünnungswärme, ![]() -
-![]() der
Unterschied des Molvolumens des Dampfes und der Lösung und
der
Unterschied des Molvolumens des Dampfes und der Lösung und ![]() der Unterschied des Dampfdruckes des
Lösungsmittels gegenüber der Lösung. Durch Integration der Gleichung lassen
sich die Siedepunktserhöhung und die Gefrierpunktserniedrigung berechnen. Bei
thermischer Dissoziation bedeutet q die Dissoziationswärme,
der Unterschied des Dampfdruckes des
Lösungsmittels gegenüber der Lösung. Durch Integration der Gleichung lassen
sich die Siedepunktserhöhung und die Gefrierpunktserniedrigung berechnen. Bei
thermischer Dissoziation bedeutet q die Dissoziationswärme, ![]() gibt die Steigung der Dissoziationsdruckkurve
an.
gibt die Steigung der Dissoziationsdruckkurve
an.
Voraussetzung für die Gültigkeit der Clausius-Clapeyron-Gleichung ist eine Volumenänderung bei der Phasenreaktion, wie es bei den genannten Beispielen der Fall ist. Sie gilt also nur für Phasenübergänge erster Art. Erweiterungen für Phasenumwandlungen höherer Art sind möglich, für solche zweiter Art z. B. erhält man
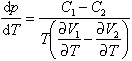
(Ehrenfestsche Gleichungen). Hierbei sind C1 und C2 die Wärmekapazitäten sowie V1 und V2 die entsprechenden Volumina. [AFM, UR]
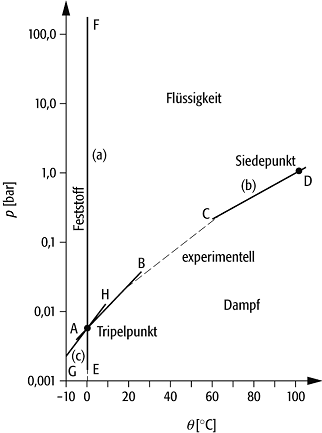
Clausius-Clapeyron-Gleichung: Phasengrenzlinie für Wasser.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.