Wasserstoffspektrum

Julian Schultheiss
Atom- und Molekülphysik, das in seiner Grobstruktur aus einer Folge von Spektrallinien, die zu Serien zusammengefasst werden können, bestehende Atomspektrum des Wasserstoffs. Die optischen Übergänge, die zu einer Spektralserie gehören, haben ein gemeinsames unteres Energieniveau. Die Spektrallinien der Balmer-Serie beispielsweise werden durch Übergänge von höheren Energieniveaus in das (n = 2)-Niveau verursacht. Die von N. Bohr berechneten Energien
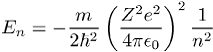
der Linien des Wasserstoffspektrums stimmen mit den experimentell beobachteten überein. Bei höherer spektraler Auflösung beobachtet man allerdings Strukturen in den Linien, die Feinstruktur und Hyperfeinstruktur der Spektrallinien. Sie werden durch die Wechselwirkung der inneren Drehimpulse des Atoms und durch relativistische und quantenelektrodynamische Effekte verursacht. Die Feinstrukturaufspaltung liegt in der Grössenordnung (a2 / n) En. Sie wird durch die relativistische Dirac-Gleichung beschrieben, aus deren Lösung man folgende Verschiebung der Energieterme erhält:
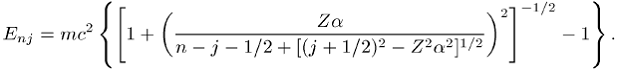
Nach der Diracschen Theorie sind das 2s1/2- und das 2p1/2-Niveau entartet. In Abb. 3 sieht man, dass dies nicht der Fall ist: Lamb und Retherford bestimmten im Jahre 1947 die Energiedifferenz zwischen den beiden Niveaus zu 0,033 cm-1 und belegten damit erstmals einen QED-Effekt experimentell.
Die Hyperfeinstruktur des Wasserstoffatoms kommt durch die Wechselwirkung des Gesamtelektronendrehimpulses mit dem Kernspin zustande. Da das magnetische Moment des Protons ungefähr um das Elektron-Proton-Massenverhältnis schwächer als das des Elektrons ist, ist auch die Hyperfeinaufspaltung der Spektrallinien entsprechend kleiner. Die Hyperfeinaufspaltung des Grundzustandes des Wasserstoffatoms ist einer der am genauesten vermessenen Übergänge; die Energiedifferenz zwischen (F = 0)- und (F = 1)-Niveau beträgt 1420 MHz (das entspricht einer Wellenlänge von 21 cm). Die 21-cm-Linie ist eine der wichtigen Linien der Astrophysik, da Wasserstoff bei weitem das häufigste Element im Universum ist.
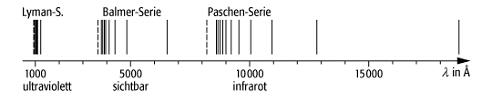
Wasserstoffspektrum 1: Linienspektrum des Wasserstoffatoms mit den drei kürzestwelligen Spektralserien.
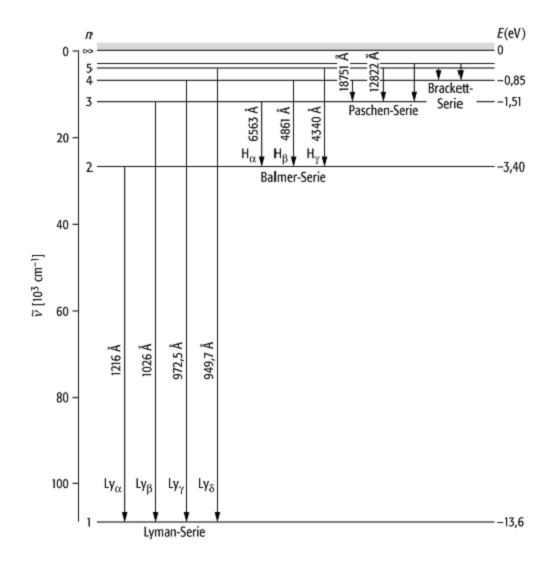
Wasserstoffspektrum 2: Energieniveaus des Wasserstoffatoms
nach dem Bohrschen Atommodell. Aufgetragen sind die Wellenzahl ![]() , die
Energie und die Wellenlängen der Übergänge in Angström.
, die
Energie und die Wellenlängen der Übergänge in Angström.
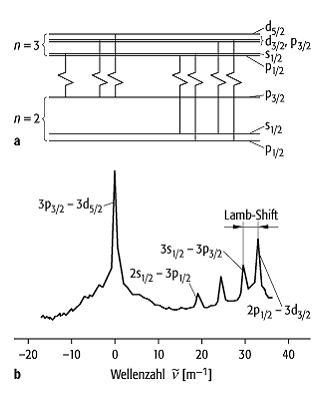
Wasserstoffspektrum 3: a) Feinstrukturaufspaltung der n = 2 und n = 3 Energieterme des Wasserstoffatoms. b) Hochaufgelöstes Spektrum der Balmer-aLinie.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.