Phasengleichgewicht

Martina Wagner
Thermodynamik und statistische Physik, ein thermodynamisches Gleichgewicht, an dem mehrere Phasen beteiligt sind und der Anteil einer Phase auf Kosten der anderen zu- oder abnehmen kann.
Haben bei diesen Phasenumwandlungen die beteiligten Phasen die gleiche Zusammensetzung, so spricht man von Phasenreaktionen. Nach der Zahl der thermodynamischen Freiheitsgrade unterscheidet man nonvariante, bivariante und multivariante Phasengleichgewichte (Gibbssche Phasenregel). Beispiele für Phasengleichgewichte sind das Schmelz-, Siede- bzw. Verdampfungs-, Sublimations- und Lösungsgleichgewicht ein- und mehrkomponentiger Systeme.
Bei einkomponentigen Systemen gibt es Zweiphasen- und Dreiphasengleichgewichte. Hingegen sind bei mehrkomponentigen Systemen eine Vielfalt von Zustandsdiagrammen möglich, die davon abhängen, bei welchen Temperaturen und Zusammensetzungen die Komponenten eine Mischphase bilden oder eine Verbindung eingehen. Im allgemeinen haben die koexistierenden Phasen nicht dieselbe Zusammensetzung. Z.B. hat der Dampf einer binären Flüssigkeit eine andere Zusammensetzung als diese selbst. Bei einigen Stoffen gibt es bestimmte Mischungsverhältnisse, bei denen beide Phasen gleiche Zusammensetzung haben, z.B. bei azeotropen Mischungen (Azeotrop) und bei der eutektischen Zusammensetzung von Legierungen (eutektisches Gemisch). Bei diesen Phasengleichgewichten gilt für Druck- und Temperaturänderungen ebenfalls die Clausius-Clapeyron-Gleichung.
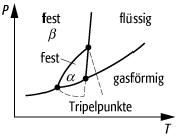
Phasengleichgewicht: Schematische Darstellung eines Zweiphasengleichgewicht.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.