Aggregatzustand

Hermann Loring
Zustandsform der Materie. Unterschieden werden der feste, der flüssige, der gasförmige und der plasmaartige (Plasma) A. , die stets vom Druck und von der Temperatur abhängig sind. Am Schmelz- bzw. Gefrierpunkt geht fester Stoff in den flüssigen bzw. flüssiger in den festen A. , am Kondensationspunkt (Kondensation) gasförmige Materie in flüssige Form über. Erscheinungsform der Stoffe. Man unterscheidet nach dem Ordnungszustand der Atome bzw. Moleküle, ihrer Wechselwirkung und ihrer Beweglichkeit die drei Aggregatzustände fest, flüssig und gasförmig.
Festkörper weisen den grössten Ordnungsgrad auf, ihre Atome oder Moleküle sind meist in Kristallgittern räumlich periodisch angeordnet, ihre Struktur ist entsprechend anisotrop. Die einzelnen Moleküle können im Kristallgitter um ihre Gleichgewichtsposition schwingen. Aufgrund der ausgeprägten Fernordnung setzen Festkörper einer Gestalts- oder Volumenänderung grossen Widerstand entgegen. Gase haben den niedrigsten Ordnungsgrad, sie sind, makroskopisch betrachtet, von isotroper räumlicher Struktur und verfügen über keine Fernordnung, so dass sie jedes verfügbare Volumen ausfüllen und beliebige Formen annehmen können. Die Nahordnung ist gleichfalls sehr schwach ausgeprägt; die Atome bzw. Moleküle eines verdünnten Gases bewegen sich dementsprechend nahezu frei nach statistischen Gesetzmässigkeiten durcheinander (kinetische Gastheorie). Flüssigkeiten nehmen eine Mittelstellung zwischen Festkörpern und Gasen ein, sie zeigen eine starke Nahordnung ihrer Atome bzw. Moleküle, aber im Gegensatz zu den Festkörpern keine Fernordnung, so dass sie, gleich den Gasen, jede beliebige Form annehmen, jedoch einer Volumenänderung starken Widerstand entgegensetzen. Flüssigkeiten sind räumlich isotrop, ihre Atome bzw. Moleküle sind gegeneinander verschiebbar und bewegen sich unregelmässig, wobei die mittlere freie Weglänge dieser Bewegung um Grössenodnungen geringer als bei Gasen ist.
Im Prinzip kann jedes Element ausser Helium jeden dieser drei fundamentalen Aggregatzustände einnehmen; die Umwandlung zwischen ihnen findet bei charakteristischen Werten von Temperatur und Druck statt (Phasenübergang). Den Aggregatzustand eines Stoffes in Abhängigkeit von den Zustandsparametern kann man in einem Zustandsdiagramm, z.B. einem p,T-Diagramm, auftragen. In einem solchen Diagramm sind die Zustandsflächen der Aggregatzustände durch Grenzkurven voneinander getrennt, auf denen die Umwandlung stattfindet.
Die einfache Einteilung in drei Aggregatzustände erfasst nicht alle vorkommenden Stoffe, es gibt Übergangsformen wie Flüssigkristalle und Gläser. Flüssigkristalle können als Flüssigkeiten charakterisiert werden, deren räumliche Anisotropie durch den Aufbau einer Kristallstruktur in einer oder zwei Raumrichtungen aufgehoben ist; sie nehmen zwar beliebige Formen an, können aber für kristalline Festkörper charakteristische Eigenschaften, wie z.B. optische Doppelbrechung, aufweisen. Unterkühlte Flüssigkeiten, die allgemein als Gläser bezeichnet werden, stellen einen Sonderfall fester Körper dar; sie sind von isotroper räumlicher Struktur, ihre Moleküle sind wie bei einer Flüssigkeit in regelloser Lage angeordnet. Speziell für polymere Substanzen kann der amorphe Zustand als der im Normalfall auftretende feste Zustand angesehen werden.
Als ein gesonderter, vierter Aggregatzustand wird oft das Plasma, der hochionisierte Zustand eines Gases, betrachtet, der sich in wichtigen charakteristischen Eigenschaften von dem eines aus Neutralteilchen bestehenden Gases unterscheidet.
Vom Begriff des Aggregatzustandes ist derjenige der thermodynamischen Phase streng zu unterscheiden, mit dem man allgemeine Inhomogenitäten eines thermodynamischen Systems beschreiben kann. So bilden z.B. zwei sich nicht mischende Flüssigkeiten einen Aggregatzustand, nämlich den flüssigen, aber zwei Phasen.
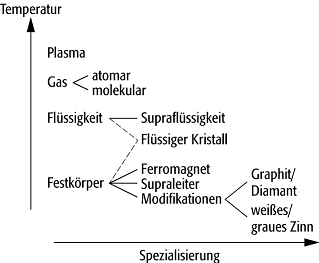
Aggregatzustand 1: Übersicht über einige ausgewählte
Phasen, die in der Natur auftreten. Die qualitative Temperaturskala bezieht
sich nur auf die links angeführten Aggreggatzustände.
character:
line-break\'>
character:line-break\'>
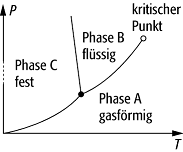
Aggregatzustand 2: p,T-Diagramm eines
einfachen Stoffes.
character:line-break\'>
character:line-break\'>
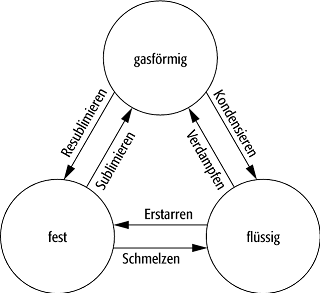
Aggregatzustand 3: Übergänge zwischen den drei fundamentalen Aggregatzuständen.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.