ideale Lösung

Manfred Schönborn
ideale Mischung, flüssige Mischung, in der eine völlige Gleichmässigkeit der
Anziehungskräfte zwischen den Teilchen besteht. Beispielsweise sind in einer
binären Lösung der Komponenten A und B die zwischenmolekularen Kräfte zwischen
A und A, B und B bzw. A und B genau gleich. Ein solches ideales Verhalten wird
von flüssigen Mischungen gezeigt, deren Komponenten sich chemisch sehr ähnlich
sind, wie z.B. Benzol und Methylbenzol. Die thermodynamische Definition einer
idealen Lösung erfolgt über die chemischen Potentiale der Komponenten. Für die
Komponente A ist das chemische Potential mA definiert als:![]()
mit ![]() , wobei
, wobei ![]() das chemische Potential der reinen Komponente
A ist, das nur von der Temperatur abhängt. Der Molenbruch xA der Komponente A in der
flüssigen Mischung ist gemäss dem Raoultschen Gesetz durch das Verhältnis des
Dampfdrucks pA von A in der flüssigen Phase zum Dampfdruck
das chemische Potential der reinen Komponente
A ist, das nur von der Temperatur abhängt. Der Molenbruch xA der Komponente A in der
flüssigen Mischung ist gemäss dem Raoultschen Gesetz durch das Verhältnis des
Dampfdrucks pA von A in der flüssigen Phase zum Dampfdruck ![]() der reinen Komponente A gegeben. Da die
zwischenmolekularen Kräfte zwischen den Komponenten A und B genauso gross sind
wie zwischen den reinen Komponenten, tritt beim Mischen keine Volumen- und
keine Enthalpieänderung auf. Das partielle molare Volumen Vj
bzw. die partielle molare Enthalpie Hj
jeder Komponente ist gleich dem molaren Volumen
der reinen Komponente A gegeben. Da die
zwischenmolekularen Kräfte zwischen den Komponenten A und B genauso gross sind
wie zwischen den reinen Komponenten, tritt beim Mischen keine Volumen- und
keine Enthalpieänderung auf. Das partielle molare Volumen Vj
bzw. die partielle molare Enthalpie Hj
jeder Komponente ist gleich dem molaren Volumen ![]() bzw. der molaren Enthalpie
bzw. der molaren Enthalpie ![]() der reinen Komponente:
der reinen Komponente: ![]() und
und ![]() .
.
Die Lösungsentropie einer idealen Lösung, die genauso gross ist
wie beim Mischen idealer Gase, ist rein statistischer Natur und auf keine
Strukturänderung zurückzuführen: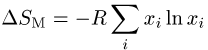 .
.
Die freie Mischungsenthalpie einer idealen Lösung ist:
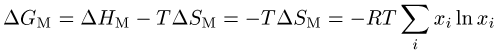 .
.
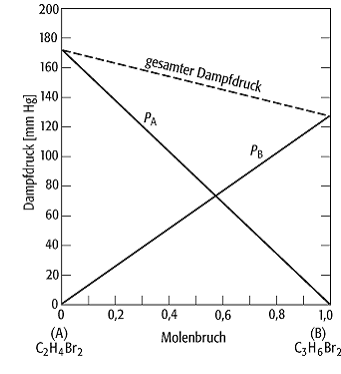
ideale Lösung: Partialdrücke und Gesamtdruck einer Lösung von Ethylenbromid und Propylenbromid bei 358 K. Das System gehorcht dem Raoultschen Gesetz.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.