Schmelzdiagramm

Hans-Peter Ahlsen
Chemie, Physikalische Chemie, Phasendiagramm, das den Zusammenhang zwischen dem festen und dem flüssigen Aggregatzustand, der Temperatur, der Anzahl der koexistenten Phasen und den Konzentrationen der Komponenten angibt. Bei zweikomponentigen Systemen zeichnet man meist die Schmelz- und Erstarrungspunkte in isobarer Darstellung; die Schmelzkurven stellen somit Isobaren dar. Bei drei- und höherkomponentigen Systemen ergeben sich räumliche p-T-x-Diagramme. Die grosse Vielzahl der Schmelzdiagramme lässt sich auf einige wenige Grundttypen und deren Kombinationen zurückführen. Diese werden danach unterschieden, ob es sich um Zwei- oder Dreistoffsysteme handelt und wie die betrachteten Komponenten sich im festen und flüssigen Zustand mischen lassen (siehe Abb. 1-9). Für alle Schmelzdiagramme, die nur stabile Phasen berücksichtigen, gilt die Gibbssche Phasenregel.
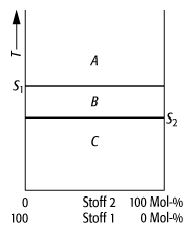
Schmelzdiagramm 1: System mit völliger Unmischbarkeit im flüssigen und festen Zustand unter Normalbedingungen (A, B, C: verschiedene Phasenräume, S1, S2: Schmelzpunkte der beiden Komponenten 1 und 2).
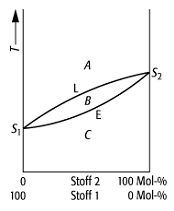
Schmelzdiagramm 2: System mit völliger Mischbarkeit im festen Zustand; die Mischkristalle liegen im Phasenraum C vor (L: Löslichkeits- oder Liquiduskurve, E: Erstarrungs- oder Soliduskurve).
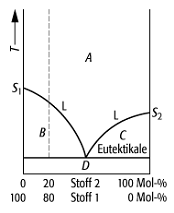
Schmelzdiagramm 3: System mit völliger Unmischbarkeit im festen Zustand und Bildung eines Eutektikums, der Mischung am eutektischen Punkt, wo das Eutektikum wie ein reiner Stoff an dieser einen, festen Temperatur erstarrt. Dort liegen 4 Phasen vor: die beiden reinen Komponenten, die Schmelze und die gasförmige Phase der Komponenten.
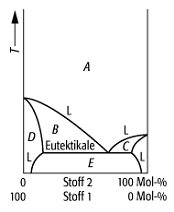
Schmelzdiagramm 4: System mit begrenzter Mischbarkeit des Eutektikums in den Randgebieten. Dieser Fall kommt häufig vor, z.B. beim Sytem Kupfer/Silber. Die Räume D und E sind mit Mischkristallen der begrenzt mischbaren Komponenten erfüllt.
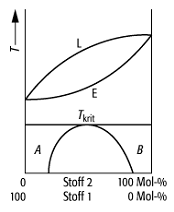
Schmelzdiagramm 5: System mit lückenloser Mischkristallbildung, die bei Temperaturerniedrigung ab einer kritischen Temperatur Tkrit unter Ausbildung einer Mischungslücke in ein Gemenge der Mischkristallarten A und B zerfallen (z.B. System Gold/Nickel).
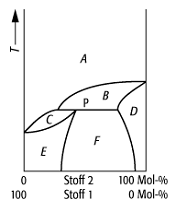
Schmelzdiagramm 6: System, bei dem die Mischungslücke bis in das Temperaturgebiet reicht, in dem die Mischkristalle aus der Schmelze gebildet werden. Es entsteht dann ein Peritektikum P, bei dem die Mischkristallart E bei Erhöhung der Temperatur in Schmelze und die Mischkristallart D zerfällt.
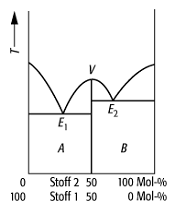
Schmelzdiagramm 7: System mit kongruent schmelzender Verbindung, die unzersetzt direkt in die Schmelze oder Lösung übergeht. Es treten stets ein Maximum (V) und zwei eutektische Punkte E1 und E2 auf.
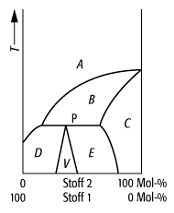
Schmelzdiagramm 8: System mit inkongruent schmelzender Verbindung V, die vor dem Schmelzvorgang in ihre Bestandteile Schmelze A und Mischkristalle C zerfällt. Die Verbindungen bilden ein Peritektikum (P).
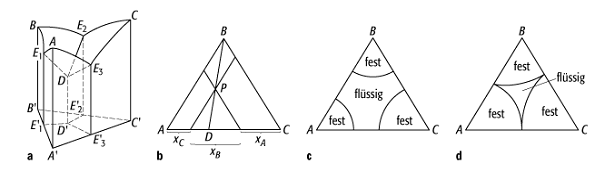
Schmelzdiagramm 9: Räumliches Modell für ein Dreistoffsystem (a) und drei Projektionen; b) Ermittlung der Konzentration eines beliebigen Punktes P durch Projektion auf die Grundfläche; parallel zur Grundfläche ausgeschnittene Isothermen c) Temperatur T1, d) bei Temperatur T2, T2 < T1.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.