Graphit

Hermann Loring
Kohlenstoff Festkörperphysik, unter normalen Druckverhältnissen die stabile Modifikation des Kohlenstoffs (C). Der Graphit besteht aus ebenen Schichten, die Kohlenstoff-Atome in den Ebenen bilden Sechserringe. Die Schichtstruktur hat eine [3]-Koordination. Die Abstände zwischen nächsten Nachbarn betragen 0,142 nm und weisen auf einen stark kovalenten Charakter der Bindung hin. Die Bindung zwischen benachbarten C-Atomen in einer Schicht ist jeweils eine s-Bindung, die aus einer sp2-Hybridisierung der C-Atome resultiert, die die ebene Anordnung der Atome mit Bindungswinkeln von 120° bewirkt. Jedes C-Atom betätigt so drei s-Bindungen, in die je eines der vier äusseren Elektronen eintritt. Die p-Orbitale der einzelnen Atome überlappen sich und führen zu p-Molekularorbitalen, die die Schichten gleichsam bedecken und den teilweise metallischen Bindungscharakter des Graphits erklären. Die Beweglichkeit der s-Elektronen bewirkt die gute elektrische Leitfähigkeit des Graphits parallel zu den Schichten, die um einen Faktor 105 grösser ist als senkrecht zu den Schichten. Der Zusammenhalt zwischen den Schichten beruht auf nur schwachen Restbindungen, was die sehr geringe Härte des Graphits erklärt. Bei der Aufeinanderfolge der Schichten sind verschiedene Stapelfolgen möglich (Polytypie).
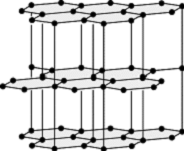
Graphit: Kristallstruktur.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.