Eloxal-Verfahren

Hans-Peter Ahlsen
Chemie, Physikalische Chemie, elektrolytischer Prozess zur Passivierung von Aluminium. Aluminium bildet auf seiner Oberfläche eine dünne (0,0001 mm), durchsichtige Oxidschicht und ist so trotz seines negativen Redox-Potentials schon geringfügig korrosionsbeständig. Diese natürliche Oxidschicht kann durch elektrolytische anodische Oxidation verstärkt werden. Dazu wird mit einer Aluminiumanode und einer meist aus Blei bestehenden Kathode verdünnte Schwefelsäure elektrolysiert. An der Kathode entsteht Wasserstoff:
2 H3O+ + 2 e- H2 + 2 H2O
Die Anodenvorgänge sind relativ komplex. Es bildet sich Sauerstoff, der, statt
zu entweichen, direkt beim Entstehen mit der Anode reagiert und so die
Aluminiumoberfläche mit einer porig aufgelockerten Oxidschicht (Abb.)
überzieht:
3 H3O+ O + 2 H3O+ + 2 e-
2 Al + 3O Al2O3
Zusätzlich können in die Poren Farbstoffe oder lichtempfindliche Substanzen (z.B. AgBr) eingebracht werden. Anschliessend wird mit Wasser die Oberfläche nachverdichtet, worauf sich die Poren verschliessen. Die Farbstoffe befinden sich nun unter der Eloxaloberfläche und sind beständig.
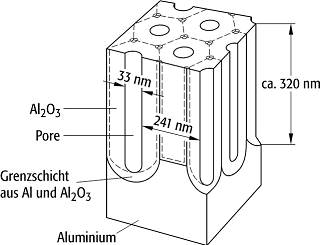
Eloxal-Verfahren: Typische Anordnung.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.