Elektronenkonfiguration der Elemente

Karl-Wilhelm Steinfieber
Chemie, Physikalische Chemie, Verteilung der Elektronen in Mehrelektronenatomen auf die Atomorbitale im Grundzustand (Atomhülle). Das Auffüllen der Atomorbitale beginnt beim 1s-Orbital - dem Orbital mit der niedrigsten Energie - gemäss der Hundschen Regel und dem Pauli-Prinzip. Die Elektronen der beiden Elemente der ersten Periode mit der Hauptquantenzahl n = 1 besetzen das 1s-Orbital: 1s1 (H), 1s2 (He). Die acht Elemente der zweiten Periode besitzen vier Orbitale mit der Hauptquantenzahl n = 2, die mit Elektronen aufgefüllt werden: 1s22s1 (Li) bis 1s22s22p6 (Ne). In der dritten Periode besetzen die Elektronen vier weitere Orbitale mit der Hauptquantenzahl n = 3: [Ne]3s1 (Na) bis [Ne]3s23p6 (Ar). Die 3d-Orbitale werden von den Elementen der dritten Periode nicht besetzt. Die Elemente der vierten Periode besetzen nach dem 4s-Orbital die 3d-Orbitale (d-Block; Übergangselemente) vor den 4p-Orbitalen mit Elektronen und trennen so die zweite und dritte Hauptgruppe voneinander. Deshalb folgen auf [Ar]4s2 (Ca) die Elektronenkonfigurationen [Ar]4s23d1 (Sc) bis [Ar]4s23d10 (Zn) und danach [Ar]4s23d104p1 (Ga) bis [Ar]4s23d104p6 (Kr). Die Besetzung der 5s-, 4d- und 5p-Orbitale der fünften Periode erfolgt analog der vierten Periode. In der sechsten Periode werden nach den 6s-Orbitalen zuerst die 4f-Orbitale (f-Block; innere Übergangselemente) besetzt, anschliessend die 5d-Orbitale und schliesslich die 6p-Orbitale. Die Orbitale der siebten Periode werden nach dem gleichen Prinzip wie in der sechsten Periode besetzt (Atomtheorie).
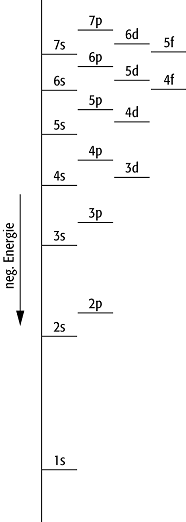
Elektronenkonfiguration der Elemente: Besetzung der s-, p-, d- und f-Orbitale im Energieniveauschema.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.