Van-der-Waals-Gleichung

Hermann Loring
Thermodynamik und statistische Physik, Zustandsgleichung zur Beschreibung wesentlicher Eigenschaften realer Gase. Sie ist durch die Formel
![]()
gegeben. Sie unterscheidet sich von der Zustandsgleichung idealer Gase pv = RT durch eine Korrektur des Druckes und des Volumens.
Es ist p der Druck, v das molare Volumen, T die Temperatur und R die allgemeine Gaskonstante; die Konstanten a und b berücksichtigen Moleküleigenschaften der realen Gase: b das Eigenvolumen der Moleküle (Kovolumen) und der Ausdruck a / v2 die gegenseitige Anziehung der Moleküle, wobei letztere Eigenschaft sich als zusätzlicher kleiner Druck auf die Gefässwände bemerkbar macht.
Die Van-der-Waals-Gleichung ermöglicht die Untersuchung von Phasenübergängen und kritischen Phänomenen realer Gase. Unter Zuhilfenahme der kritischen Zustandsgrössen für den Druck pk, das molare Volumen vk und der Temperatur Tk lässt sich die Van-der-Waals-Gleichung in den dimensionslosen reduzierten Grössen pr = p / pk, vr = v / vk, Tr = T / Tk aufschreiben:
![]()
Diese Gleichung ist von einer speziellen Substanz unabhängig. Betrachtet man unterschiedliche Substanzen bei denselben reduzierten Zustandsgrössen, so nennt man die zugehörigen Zustände korrespondierende Zustände. Die Gaskonstante ergibt sich daraus zu
![]()
Die experimentell bestimmten Werte Rexp unterscheiden sich
jedoch vom theoretischen Wert oft beträchtlich; für CO2 etwa ist Rexp
/ R » 0,73. Das liegt daran, dass die
Van-der-Waals-Gleichung insbesondere am kritischen Punkt und im flüssigen
Bereich die thermodynamischen Grössen quantitativ nicht richtig erfasst. Liegen
die Phasen flüssig und gasförmig nebeneinander im Gleichgewicht vor, so erfolgt
die Zustandsänderung zwischen diesen nicht entlang einer Isothermen, sondern
entlang der Geraden ![]() , der
Maxwell-Geraden (siehe Abb.), deren Verlauf durch das Maxwellsches Kriterium
bestimmt wird.
, der
Maxwell-Geraden (siehe Abb.), deren Verlauf durch das Maxwellsches Kriterium
bestimmt wird.
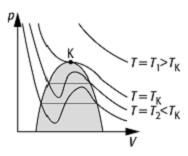
Van-der-Waals-Gleichung: p-V-Diagramm für eine Schar von Isothermen (![]() ) und
kritischer Punkt K. Im grau unterlegten Bereich findet der Phasenübergang
flüssiggasförmig statt. Die waagerechten Linien sind die Maxwellschen Geraden.
) und
kritischer Punkt K. Im grau unterlegten Bereich findet der Phasenübergang
flüssiggasförmig statt. Die waagerechten Linien sind die Maxwellschen Geraden.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.