Hydratationsenthalpie

Petra Nordinghaus-Martin
Hydratationsenergie, die Standardenthalpieänderung bei der (hypothetischen) Überführung von Ionen aus der Gasphase (g) in die wässrige, stark verdünnte Lösung (Hydratation, (aq)), z.B.:
Na+ (g) + Cl- (g) ![]() Na+
(aq) + Cl- (aq).
Na+
(aq) + Cl- (aq).
Die Hydratationsenthalpie DHydH° für diesen
Prozess beträgt -783,4
kJ mol-1. Sie lässt sich mit Hilfe eines
thermodynamischen Kreisprozesses bestimmen, der analog dem
Born-Haber-Kreisprozess zur Bestimmung der Gitterenergie von Ionenverbindungen
aufgebaut ist (Abb.). Die Hydratationsenthalpien von Kationen hängen mit der
Ionenladung z und dem effektiven Ionenradius reff
(=
Ionenradius nach Pauling + Radius des Sauerstoffs im Wassermolekül) wie folgt zusammen: ![]() . Die
Hydratationsenthalpie eines Kations ist um so grösser, je höher seine
Ionenladung und je kleiner sein Radius ist.
. Die
Hydratationsenthalpie eines Kations ist um so grösser, je höher seine
Ionenladung und je kleiner sein Radius ist.
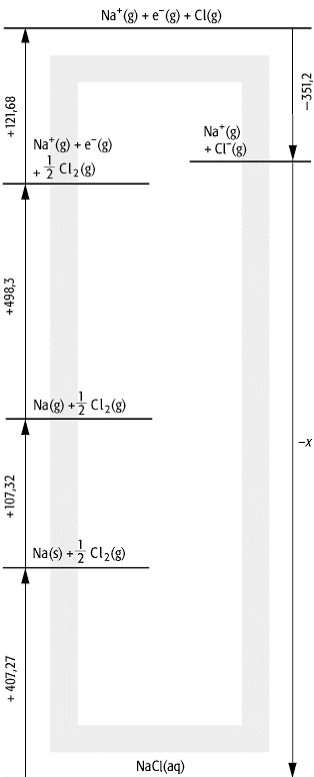
Hydratationsenthalpie: Thermodynamischer Kreisprozess zur Bestimmung der Hydratationsenthalpie von Na+ und Cl-.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.