Carnotscher Kreisprozess

Julian Schultheiss
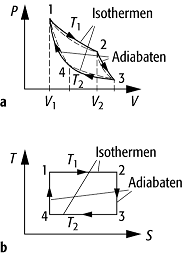
Carnot-Prozess, von S. Carnot 1824 entwickelter reversibler thermodynamischer Kreisprozess, der aus je zwei Isothermen und Adiabaten besteht. Der Carnotsche Kreisprozess bildet die theoretische Grundlage zur Berechnung des Wirkungsgrades aller (periodisch arbeitenden) Wärmekraftmaschinen. Ihm liegt folgendes Gedankenexperiment zugrunde: Die Arbeitssubstanz, für üblich ein Gas, befindet sich in einem Zylinder mit einem beweglichen Kolben und kann mit einem Thermostaten der absoluten Temperatur T1 und einem weiteren Thermostaten der niedrigeren absoluten Temperatur T2 Wärme austauschen. Es läuft nun ein Zyklus von vier Teilprozessen ab (Abb.):
1) Isotherme Expansion bei T = T1: Die Substanz wird zunächst mit dem Wärmebehälter der Temperatur T1 in Wärmekontakt gebracht und vergrössert dann bei der Expansion unter Arbeitsleistung ihr Volumen von V1 auf V2. Dabei wird einerseits dem Wärmebehälter die Wärme Q1 entzogen und andererseits Arbeit nach aussen abgegeben.
2) Adiabatische Expansion: Die Substanz wird unter weiterer Arbeitsleistung so weit expandiert, bis sie sich auf die Temperatur T2 abgekühlt hat.
3) Isotherme Kompression: Die Substanz wird mit dem Wärmebehälter der Temperatur T2 in Wärmekontakt gebracht und unter Aufwendung äusserer Arbeit isotherm komprimiert. Dabei wird die Wärme Q2 abgegeben.
4) Adiabatische Kompression: Die Substanz wird unter weiterer Aufwendung äusserer Arbeit komprimiert, bis sie die Temperatur T1 wieder erreicht hat. Die Substanz befindet sich damit wieder in ihrem Anfangszustand.
Wesentlich ist, dass alle Prozesse reversibel ablaufen, d.h., sie können auch in umgekehrter Richtung verlaufen (Wärmepumpe, Kältemaschine).
Der Wirkungsgrad des Carnotschen Kreisprozesses, der
Carnotsche Wirkungsgrad hC, definiert als Quotient aus nach aussen abgegebener Arbeit
und aufgenommener Wärme, lässt sich aus den ersten beiden Hauptsätzen der
Thermodynamik berechnen: Nach dem ersten Hauptsatz muss die gewonnene Arbeit W
= Q1 - Q2 sein. Wegen der
Reversibilität des Prozesses gilt ausserdem nach dem zweiten Hauptsatz, dass sich
insgesamt die Entropie nicht ändert, also ![]() . Diese
Beziehung reduziert sich auf Q1/T1 - Q1/T2 = 0, da für die beiden adiabatischen Prozesse
. Diese
Beziehung reduziert sich auf Q1/T1 - Q1/T2 = 0, da für die beiden adiabatischen Prozesse ![]() gilt und die Isothermen in entgegengesetzter
Richtung durchlaufen werden (
gilt und die Isothermen in entgegengesetzter
Richtung durchlaufen werden (![]() :
unvollständiges Differential). Die ausgetauschten Wärmemengen verhalten sich
wie die zugeordneten absoluten Temperaturen. Damit erhält man für den
Carnotschen Wirkungsgrad:
:
unvollständiges Differential). Die ausgetauschten Wärmemengen verhalten sich
wie die zugeordneten absoluten Temperaturen. Damit erhält man für den
Carnotschen Wirkungsgrad:
![]() .
.
hC ist also stets kleiner als eins; sein Wert ist unabhängig von der verwendeten Arbeitssubstanz. (Carnotsche Theoreme)
Carnotscher Kreisprozess: a) p,V-Diagramm des
Carnotschen Kreisprozesses. p ist der Druck, den das Gas auf den Kolben
ausübt, V das Gasvolumen. Die gestrichelten Kurven stellen einen realen
Carnot-Prozess dar. Die umschlossene Fläche ist gleich der Arbeit ![]() , die bei einem
Zyklus geleistet wird; b) besonders einfach lässt sich der Carnotsche
Kreisprozess im T,S-Diagramm wiedergeben. T und S
sind die Temperatur bzw. die Entropie des Gases. Die beiden Isothermen sind die
beiden waagerechten Geraden T = T1 und T = T2,
während die beiden Adiabaten durch die senkrechten Geraden (S = const.)
dargestellt werden, da sich die Entropie S bei einem reversiblen adiabatischen
Prozess nicht ändert.
, die bei einem
Zyklus geleistet wird; b) besonders einfach lässt sich der Carnotsche
Kreisprozess im T,S-Diagramm wiedergeben. T und S
sind die Temperatur bzw. die Entropie des Gases. Die beiden Isothermen sind die
beiden waagerechten Geraden T = T1 und T = T2,
während die beiden Adiabaten durch die senkrechten Geraden (S = const.)
dargestellt werden, da sich die Entropie S bei einem reversiblen adiabatischen
Prozess nicht ändert.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.