Boyle-Mariottesches Gesetz

Hans-Peter Ahlsen
Ideales Gas Boylesches Gesetz, 1662 von R. Boyle entdeckte und 1676 von E. Mariotte experimentell bestätigte Gesetzmässigkeit, die den Verlauf der Isothermen im p,V-Diagramm idealer Gase beschreibt:
pV = const.
(Abb.). Dabei ist p der Druck, V das Volumen und
T die Temperatur. Reale Gase genügen diesem Gesetz um so besser, je eher
das Eigenvolumen der Gasmoleküle vernachlässigt werden kann, je höher also die
Temperatur T und je geringer der Druck p ist. Die Abweichungen
vom idealen Verhalten können bei hohen Drücken beträchtlich werden. Viele reale
Gase, z.B. Luft und Wasserstoff, gehorchen dem Boyle-Mariotteschem Gesetz unter
normalen Bedingungen sehr gut. Die Grösse ![]() , als Funktion
des Druckes aufgetragen, gibt eine gute Übersicht über das Verhalten der
einzelnen Gase (Abb.).
, als Funktion
des Druckes aufgetragen, gibt eine gute Übersicht über das Verhalten der
einzelnen Gase (Abb.).
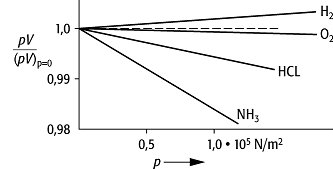
Boyle-Mariottesches Gesetz: Isothermen eines idealen (gestrichelt) und von realen (durchgezogen) Gasen.
Techniklexikon.net
Das freie Technik-Lexikon. Fundierte Informationen zu allen Fachgebieten der Ingenieurwissenschaften, für Wissenschaftler, Studenten, Praktiker & alle Interessierten. Professionell dargeboten und kostenlos zugängig.
Techniklexikon
Modernes Studium der Physik sollte allen zugängig gemacht werden.